COVIDの由来:手がかりを探る
武漢でパンドラの箱を開けたのは、人なのか、自然なのか?
●ニコラス・ウェイド
イギリスのサイエンスライター。「Nature」や「Science」、そして長年にわたり「New York Times」のスタッフとして勤める。NYタイムズの彼の記事一覧。
武漢ウイルス研究所の安全対策について
何度も流出事故を起こしているウイルス研究の歴史
ダザック博士は、どんなに優れた研究所でもウイルスが流出するという長い歴史を知らなかったのかもしれないし、よく知っていたのかもしれない。
天然痘ウイルスは、1960年代から1970年代にかけて、イギリスの研究所から3回流出し、80人の患者と3人の死者を出した。その後も毎年のように危険なウイルスが研究室から流出している。最近では、SARS1ウイルスは、シンガポール、台湾の研究所から流出し、北京の中国国立ウイルス研究所からも4回以上流出したまさに逃亡者である。
SARS1の対応が困難だった理由の一つは、実験室で働く人を守るためのワクチンがなかったことである。ダザック博士が12月19日のインタビューで述べたように、武漢の研究者たちも、人間の細胞に感染するように設計されたコロナウイルスに対するワクチンを開発することができていなかった。
彼らは、もしSARS2が自分の研究室で作られたとしたら、北京の同僚がSARS1に対抗したのと同じように、無防備だっただろう。
新型コロナウイルスが深刻な危険にさらされている2つ目の理由は、実験室の安全レベルと関係がある。安全性にはBSL1からBSL4までの4段階があり、BSL4は最も厳しく、エボラウイルスのような致命的な病原体のために設計されている。
武漢ウイルス学研究所には新しく設立されたBSL4実験室があったが、その状態は、2018年に北京大使館から訪れた国務省の検査官をかなり警戒させた。
「新しいラボでは、高度密閉ラボを安全に運営するために必要な適切な訓練を受けた技術者や調査員が深刻に不足している」と、検査官は2018年1月19日の電報に記している。
しかし、本当の問題は、武漢のBSL4ラボが安全ではないということではなく、世界中のウイルス学者がBSL4環境での作業を好まないということである。
宇宙服を着て、密閉されたキャビネットの中で作業を行い、すべての動作で2倍の時間がかかる環境を受け入れる必要がある。そのため、ウイルスの種類ごとに安全レベルを決めるルールは、慎重さを欠いたものになってしまった。
BS2レベルで研究されていた危険な研究
2020年以前、中国やその他の地域のウイルス学者が従っていたルールでは、SARS1やMERSウイルスの実験はBSL3の条件で行わなければならなかった。
しかし、それ以外のコウモリコロナウイルスは、下のレベルであるBSL2で研究することができた。BSL2では、白衣や手袋を着用する、ピペットで液体を吸い上げない、バイオハザードの警告表示をするなど、かなり最低限の安全対策だけだった。
しかし、BSL2で機能を強化した実験を行えば、SARS1やMERSよりも感染力の高い病原体を作り出すことができるかもしれない。その場合、特にワクチンを接種していない研究者は、高い確率で感染することになる。
コロナウイルスの機能獲得に関する石博士の研究の多くは、彼女の出版物やその他の文書に記載されているように、BSL2の安全レベルで行われた。
彼女はScience誌のインタビューで、「私たちの研究所でのコロナウイルス研究はBSL-2またはBSL-3の実験室で行われている」と語っている。

「作業の一部または全部が、米国の一般的な歯科医院のバイオセーフティーレベルであるバイオセーフティーレベル2で行われていたことは明らかです。SARS-CoV-2のような感染特性を持つウイルスに接触した場合、実験室のスタッフが感染するリスクは許容できないほど高い」とエブライト博士は語る。
また、「この研究は資金提供を受けるべきではなかったし、実施すべきではなかったことも明らかです」と付け加えている。
これは、SARS2ウイルスが研究室の中に入ってきたかどうかにかかわらず、彼の見解である。
武漢の研究所の安全性に対する懸念は、決して見当違いではなかったようだ。国務省が2021年1月15日に発表したファクトシートによると
「米国政府は、WIV内部の複数の研究者が、最初に確認されたアウトブレイクの症例よりも前の2019年秋に、COVID-19や一般的な季節性疾患の両方に一致する症状で体調を崩したと思われる出来事がある」と記載されている。
ハドソン研究所の研究員で、元国務省のコンサルタントであるデビッド・アッシャーは、セミナーでこの事件について詳しく説明した。事件に関する詳細は、公開情報と「私たちの諜報グループが収集されたいくつかのハイエンド情報」の組み合わせを元にしていると彼は言っている。
同研究所のBSL3実験室で働いていた3人が1週間以内に体調を崩し、入院を必要とする重篤な症状となった。これは、「COVID-19と思われる感染者の集団発生としては、我々が知る限り初めてのことである」とのことであるという。インフルエンザを完全に否定することはできないが、この状況ではありえないだろう、と彼は言った。
SARS2の起源をめぐる対立するシナリオの比較
これらの証拠を考慮すると、SARS2ウイルスは研究室で作られ、そこから流出した可能性があるという重大な事件となる。しかし、この事件は、いくら充実しているとはいえ証拠にはいたらない。
証拠となるのは、武漢ウイルス研究所、または武漢の関連研究所が、SARS2またはその前身となるウイルスを開発中であったことを示す証拠である。
このような記録を入手できない場合は、SARS2ウイルスに関するある重要な事実を取り上げ、自然発生と研究所流出という2つの対立する起源のシナリオで、それぞれがどの程度説明できるかを問うという方法もある。
ここでは、2つの仮説に対する4つの検証を紹介する。いくらか専門的な内容が含まれているが、これらは議論を追いかけたい人にとって最も説得力のあるものである。
1:発祥地
まずは地理的観点から。SARS2ウイルスの最も近い親戚である2種類のウイルスは、中国南部の雲南省の洞窟に住むコウモリから採取された。
もしSARS2ウイルスが雲南省の洞窟周辺に住む人々に最初に感染したのであれば、ウイルスが自然に人に伝播したという考えを強く支持することになる。しかし、実際にはそうではなかった。1500キロ離れた武漢でパンデミックが発生したのである。
SARS2が属するコウモリウイルスの仲間であるβ-コロナウイルスは、中国南部に生息するカブトコウモリ ライノフィンコウモリに感染する。コウモリの行動範囲は50kmなので、武漢まで来ることはないと思われる。いずれにしても、湖北省ではコウモリが冬眠するほど気温が低くなる9月にCOVID-19のパンデミックの最初の症例が発生したと考えられる。
もし、コウモリのウイルスが最初に中間宿主に感染したとしたらどうだろうか? そのためには、中間宿主と頻繁に接触するコウモリの集団が長年にわたって存在する必要があり、その集団は人間と頻繁に交わる必要がある。
このようなウイルスの交流は、武漢以外のどこかで行われているに違いない。武漢は混雑した大都市であり、知られている限りではライノロフィンコウモリのコロニーの自然な生息地ではない。
この感染性の高いウイルスを持っている感染者(または動物)は、他の人に感染させることなく武漢に移動したのだろう。その人の家族は誰も病気にならなかった。その人が武漢行きの列車に飛び乗ったとしても、同僚の乗客は誰も病気にならなかった。
つまり、武漢以外の場所で自然発生したパンデミックが、何の痕跡も残さずに武漢に初上陸するというのは無理があるのだ。
実験室からの脱出というシナリオでは、ウイルスの起源が武漢であることは当然のことである。武漢は中国のコロナウイルス研究の中心地であり、前述のように、研究者たちはコウモリのコロナウイルスを人間の細胞を攻撃できるように遺伝子操作していた。
彼らはBSL2実験室という最低限の安全条件の下でそれを行っていた。そこにSARS2のような予想外の感染力を持つウイルスが生成されていたとしたら、その逃亡も不思議ではない。
2.自然と進化
パンデミックの初期発生場所は、その自然史という大きな問題のごく一部です。ウイルスは、ある種の生物から別の種の生物へと一度だけ飛び移るわけではない。
コロナウイルスのスパイクタンパク質は、他の種への飛び移りを繰り返し、そのほとんどが失敗に終わった後、幸運な突然変異が発生する。変異とは、RNAユニットの1つが変化することで、スパイクタンパク質に別のアミノ酸ユニットが組み込まれることで、スパイクタンパク質が他の種の細胞を攻撃できるようになることである。
このような突然変異による調整を何度も繰り返することで、ウイルスは新しい宿主、例えばコウモリが頻繁に接触する動物に感染させる。このプロセスは、ウイルスがこの中間宿主から人間へと感染する際に繰り返される。
SARS1の場合、研究者たちは、ウイルスが危険な病原体へと段階的に進化していく過程で、スパイクタンパク質が次々と変化していく様子を記録している。コウモリからハクビシンに移った後、スパイクタンパク質に6回の変化があって、人間には軽度の病原体になった。さらに14回の変化を経て、ウイルスは人間への適応性を高め、さらに4回の変化を経て、流行が始まったのである。
しかし、SARS2に同様の変遷の痕跡を探してみると、奇妙な驚きにあう。このウイルスは、少なくとも最近まで、ほとんど変化していなかったからである。現れた当初から、人間の細胞によく適応していたのである。
ブロード研究所のアリナ・チャン率いる研究者たちは、SARS2と、その時点でヒトの細胞によく適応していた後期のSARS1を比較した。
「2019年後半にSARS-CoV-2が初めて検出されたときには、すでに晩期流行型SARS-CoVと同様の程度までヒトへの感染に事前適応していた」と、研究者たちは述べている。
研究室由来の可能性は低いと考える人でも、SARS2のゲノムが驚くほど均一であることには同意している。
バリック博士は、「中国の武漢で確認された初期の株は、遺伝子の多様性が限られており、このウイルスが単一の供給源から持ち込まれた可能性を示唆している」と書いている。
単一のソースは、もちろん実験室での流失説としては最もなものとなるが、自然進化史においては、その特徴である大量の多様性と選択には適していない。
SARS2のゲノムは均一な構造をしており、中間的な動物宿主を経由したことを示唆するものはなく、自然界でもそのような宿主は確認されていない。
自然発生説を支持する人たちは、SARS2がまだ見つかっていない人間集団の中で潜伏し、その特殊性を獲得したと考えている。あるいは、中国国外の宿主動物に飛び火したのではないかとも言われている。確かにこうした推測はすべて可能だが、苦しいものである。研究室流出の支持者は、もっと単純な説明をしている。
SARS2は、ダザック博士の助成金申請書に記載されているように、ヒト化マウスや実験室で培養されたヒト細胞で増殖したため、最初からヒト細胞に適応していたのである。実験室での培養の特徴は均一性であるため、そのゲノムにはほとんど多様性が見られない。
実験室流出論者は、SARS2ウイルスが人に感染する前に中間宿主種に感染したのは当然であり、それを特定したのは武漢ウイルス学研究所のヒト化マウスだと冗談を言う。
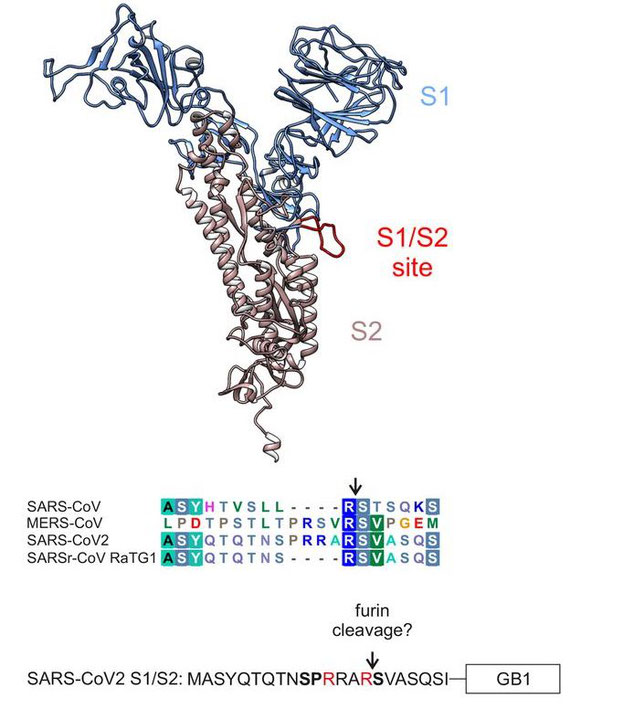
3.フーリン切断部位
フーリン切断部位は、ウイルスの構造の中ではごくわずかな部分だが、感染力に大きな影響を与えるものである。この部位は、SARS2のスパイクタンパク質の中央部に位置しており、ウイルスがどこから来たのかという謎を解く鍵となっている。
スパイクタンパク質には、役割の異なる2つのサブユニットがある。S1と呼ばれるサブユニットは、ウイルスの標的であるアンジオテンシン変換酵素2(ACE2)と呼ばれるタンパク質を認識する。
2つ目のS2は、細胞に固定されたウイルスが細胞の膜と融合するのを助ける。ウイルスの外膜が被害を受けた細胞の外膜と融合した後、ウイルスゲノムが細胞に注入され、細胞のタンパク質生成装置を乗っ取り、新しいウイルスを生成させる。
しかし、S1サブユニットとS2サブユニットが切り離されるまで侵攻は始まらない。そして、S1とS2の接合部には、フーリン切断部位があり、そこがスパイクタンパク質が正確な場所で切断されることを保証している。
経済設計のモデルのウイルスは、自分自身の切断機能を持っていない。細胞が持つ切断機能に依存している。人間の細胞は、その表面に「フーリン」と呼ばれるタンパク質切断機能を持っている。フーリンは、その特徴的な標的切断部位を持つあらゆるタンパク質鎖を切断する。
これは、アミノ酸単位のプロリン-アルギニン-アラニンの配列であり、各アミノ酸をアルファベットで参照するコードではPRRAと呼ばれる。PRRAは、SARS2のフーリン切断部位の核となるアミノ酸配列である。
ウイルスにはさまざまな巧妙な仕掛けがあるが、なぜフーリン切断部位が際立って特徴だろうか? なぜならSARS関連のβコロナウイルスの中で、SARS2だけがフーリン切断部位を持っているからだ。他のウイルスは、S2ユニットが別の場所で別のメカニズムで切断されている。
では、SARS2はどのようにしてフーリン切断部位を獲得したのだろうか?自然に進化したのか、あるいは研究者がS1/S2接合部に挿入して機能獲得実験を行ったのか、どちらなのだろうか。
まずは自然界の起源を考えてみよう。ウイルスの進化には、「突然変異」と「組み換え」の2つがある。突然変異とは、DNA(コロナウイルスの場合はRNA)がランダムに変化する過程で、通常、タンパク質鎖のあるアミノ酸が別のアミノ酸に入れ替わることを言う。
このような変化の多くはウイルスに悪影響を与えるが、自然淘汰によって有用な働きをするものが残る。突然変異は、SARS1のスパイクタンパク質が、好んで標的とする細胞をコウモリからハクビシン、そして人間へと徐々に変えていく過程である。
SARS2のフーリン切断部位は、完全には否定できないにしても、変異によって生成される可能性は低いと思われる。
サイトの4つのアミノ酸ユニットが揃っており、S1/S2接合部のちょうど良い位置にある。突然変異は、コピーエラー(新しいウイルスゲノムが生成されるとき)やゲノムユニットの化学的崩壊によって引き起こされるランダムなプロセスである。
そのため、通常はタンパク質鎖の異なる場所にある単一のアミノ酸に影響を与える。フーリンの切断部位のような一連のアミノ酸は、「組換え」と呼ばれる全く別のプロセスによって一斉に獲得される可能性がはるかに高い。
組換えとは、2つのウイルスがたまたま同じ細胞に侵入し、その子孫がもう一方のウイルスのRNAの断片で組み立てられたときに起こる、ゲノム物質の不注意な入れ替えのことである。β-コロナウイルスは、他のβ-コロナウイルスとしか結合しないが、組み換えによって、集団のゲノムプールに存在するほとんどすべての遺伝的要素を獲得することができる。
自然発生説の支持者は、SARS2はまだ知られていないベータコロナウイルスからこの部位を拾ったのではないかと言う。しかし、コウモリのSARS関連βコロナウイルスは、コウモリの細胞に感染するのにフーリン切断部位を必要としないことが明らかになっているので、実際にフーリン切断部位を持っている可能性は低いし、実際にこれまで見つかっていない。
次の提案者の主張は、SARS2が人間からフーリン切断部位を獲得したというものだ。SARS2の前身は、数カ月から数年にわたって人の間で循環していたかもしれないが、ある時点で人の細胞からフーリン切断部位を獲得したのかもしれない。そうすれば、パンデミックを起こす準備が整ったことになる。
もしそうであれば、病院の監視記録に、ゆっくりと進化するウイルスに感染した人たちの痕跡が残っているはずだ。しかし、今のところ、そのような記録はない。
ウイルスの起源に関するWHOの報告書によると、武漢のある湖北省のセンチネル病院では、日常的にインフルエンザ様疾患を監視しており、「12月の流行に先立つ数ヶ月間にSARSCoV-2の実質的な感染を示唆する証拠は観察されなかった」としている。
そのため、SARS2ウイルスがどのようにして突然変異や組み換えによって自然にフリン切断部位を手に入れたのかを説明するのは難しい。
残るは機能獲得の実験だ。SARS2が実験室から流失したのではないかと考えている人にとっては、フーリン切断部位の説明は全く問題ない。
「1992年以来、ウイルス学界では、ウイルスをより死に至らしめる確実な方法は、実験室でS1/S2接合部にフーリン切断部位を与えることだとわかっている」と、SARS2の起源に関心を持つバイオテック企業家のスティーブン・クエイ博士は書いている。
武漢ウイルス研究所のコロナウイルス研究責任者である石博士をはじめ、ウイルスの感染力を高めるためにフーリン切断部位を挿入する機能獲得実験が、少なくとも11件公開されている。